- CARBOCHIMIE ET PÉTROCHIMIE - Pétrochimie
- CARBOCHIMIE ET PÉTROCHIMIE - PétrochimieLa chimie des dérivés du pétrole, dont le nom est aujourd’hui abrégé, improprement sans doute, en «pétrochimie», a connu un développement spectaculaire dès lors qu’il a été possible de puiser dans les immenses réserves d’hydrocarbures liquides ou gazeux que recèle le sous-sol et dont la découverte a été accélérée par l’accroissement des besoins énergétiques du monde. En effet, dès la mise en valeur des premiers gisements pétrolifères, les chimistes ont rapidement reconnu qu’il y avait là une source nouvelle de matière hydrocarbonée appelée à remplacer progressivement les matériaux d’origine naturelle. Dès 1892, Mendeleïev, visitant les champs pétrolifères de Pennsylvanie, écrivait au gouvernement du tsar: «Ce matériel est trop précieux pour être brûlé; quand nous brûlons du pétrole, nous brûlons de l’argent; il faut l’utiliser comme matière première de la synthèse chimique.»Il a fallu, cependant, attendre de nombreuses années pour que le pétrole représente une fraction significative de l’approvisionnement en substance carbonée de l’industrie chimique. C’est, en effet, d’abord aux dérivés de la houille que l’on s’adressa pour y trouver des matériaux de base, sous-produits de la fabrication du coke dont l’industrie métallurgique, alors en plein essor, devenait grande consommatrice.Pendant cette même période, le pétrole constituait progressivement une source d’énergie de plus en plus importante dont on adaptait les techniques pour faire face à de nouveaux marchés (éclairage, chauffe, traction). C’est parmi les sous-produits de ces techniques que furent trouvées initialement les matières premières pour la chimie. En 1920, aux États-Unis, l’Union Carbide Chemicals Co. et la Standard Oil Company of New Jersey produisaient à elles seules soixante-quinze tonnes de produits chimiques par an; la première fabriquait des dérivés de l’éthylène obtenu par craquage de l’éthane, extrait luimême par liquéfaction du gaz naturel; la seconde entreprit la fabrication de l’alcool isopropylique à partir d’un gaz issu du craquage thermique des hydrocarbures, opération dont le but principal était la production d’essence.À ces deux pionniers se joignent bientôt d’autres sociétés (Dow Chemical en 1929, Monsanto en 1936); mais c’est à partir de la Seconde Guerre mondiale que le rythme de croissance de la pétrochimie se modifie complètement. Dès 1945, la production de butadiène par déshydrogénation des butènes atteint 500 000 t/an aux États-Unis. En 1942, en Europe, British Celanese produit 6 000 t/an d’éthylène. En 1946, Shell, à partir des gaz issus des opérations de raffinage du pétrole, construit le premier complexe pétrochimique européen, pour la production de composés oxygénés utilisés en grande partie comme solvants. En France, la production d’éthylène commence en 1953 à Lavéra dans une usine de naphtachimie; elle se poursuit à Lacq qui devient, grâce à l’importance du gisement de gaz naturel, une plate-forme pétrochimique où s’installent progressivement des usines qui produisent l’acétylène, le méthanol, l’ammoniac, l’éthylène et le benzène.Dès lors, la part du pétrole dans la chimie organique ne cesse de croître. Aux États-Unis, elle atteint 50 p. 100 en 1950 et plus de 97 p. 100 aujourd’hui. En Europe, en 1950, 4 p. 100 seulement des composés organiques sont d’origine pétrolière; mais la conversion de l’industrie chimique a été rapide: actuellement, 90 p. 100 du carbone contenu dans les produits organiques proviennent du pétrole.En 1980, l’industrie pétrochimique a fabriqué 165 millions de tonnes de produits organiques et engrais dont la valeur, à l’exclusion des produits de l’industrie pharmaceutique, atteint 2 000 milliards de francs.Depuis 1974, l’augmentation des prix du pétrole a provoqué un accroissement de 150 p. 100 du coût des matières premières de la pétrochimie. De ce fait, certaines transformations fondées sur des produits agricoles sont devenues à nouveau compétitives avec les productions pétrochimiques. C’est le cas des huiles végétales dans la fabrication d’alcools pour certains types de détergents. Dans l’avenir, le charbon peut redevenir une source de carbone organique, par exemple pour la fabrication du méthanol et de ses dérivés.1. Principaux produits chimiques issus du pétroleDès lors que le pétrole, dans la fabrication des produits chimiques, tend à devenir la source unique de matières premières, on peut considérer que la quasi-totalité des substances organiques est constituée par les produits pétrochimiques. Ils ont atteint, dans trois domaines particuliers, une importance telle que chacun peut l’éprouver dans la vie quotidienne (polymères, engrais azotés, détergents).Les polymèresLes polymères organiques occupent une place prépondérante dans les produits de la pétrochimie. En 1990, la production annuelle totale a atteint 125 millions de tonnes, soit 24 kg par an et par habitant. Ces polymères sont de natures très diverses, et chacun d’eux est destiné à un usage particulier correspondant à des propriétés spécifiques.Les caoutchoucs de synthèse ou élastomèresLes principaux caoutchoucs de synthèse sont le polybutadiène, le poly(butadiène-styrène) S.B.R. (Styrène-Butadiène-Rubber), le polyisobutylène (caoutchouc butyl). Ils sont largement utilisés, avec le caoutchouc naturel, dans la fabrication des pneumatiques et des chambres à air. D’autres, moins importants par la quantité, sont des substances de spécialité dont l’industrie fait usage pour résoudre des problèmes particuliers (utilisation en conditions extrêmes, froid, chaleur, lumière ultraviolette, emploi en présence de produits corrosifs, ou sous fortes contraintes mécaniques). Il s’agit, par exemple, du polychloroprène, du poly(butadiène-acrylonitrile) [caoutchouc nitrile] apprécié à cause de sa résistance aux solvants organiques, du poly(éthylène-propylène), connu pour sa résistance aux intempéries.Les fibresLes fibres synthétiques représentent un deuxième groupe de polymères qui ont, en partie, supplanté les produits naturels (soie, laine, coton, chanvre). La plus connue d’entre elles est le Nylon, dont il existe plusieurs variétés. La première, introduite par DuPont de Nemours en 1939, est appelée Nylon-6,6, car ce produit résulte de la polycondensation d’un diacide organique à six atomes de carbone, l’acide adipique [HOOC 漣 (CH2)4 漣 COOH], avec une diamine à six atomes de carbone également [NH2 漣 (CH2)6 漣 NH2], l’hexaméthylène diamine.Par la suite, d’autres types de Nylon ont été fabriqués: le Nylon-6 résulte de la polymérisation d’une substance à six atomes de carbone, le caprolactame:
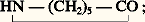 le Nylon-12 est le résultat de la polymérisation du lauryl lactame:
le Nylon-12 est le résultat de la polymérisation du lauryl lactame: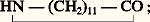 par ses propriétés, il est très proche du Nylon-11 vendu en France sous le nom de Rilsan, dont le monomère est tiré de l’huile de ricin. Un autre type de fibre est fabriqué à partir d’un polyester obtenu par polycondensation d’un acide organique, l’acide téréphtalique (HOOC 漣 C6H4 漣 COOH), avec l’éthylène glycol (HOCH2 漣 CH2OH). Il est connu sous des noms commerciaux très divers (Tergal, Térylène, par exemple).Il existe aussi des fibres acryliques et vinyliques, qui doivent une large part de l’intérêt qu’on leur porte à la facilité que l’on a de les mélanger avec des fibres naturelles et avec de la laine en particulier. Le polymère acrylique est obtenu par polymérisation de l’acrylonitrile (CH2=CH 漣 CN). Le polymère vinylique l’est à partir de l’acétate de vinyle (CH3COO 漣 CH=CH2); cette fibre a progressivement supplanté une fibre artificielle obtenue à partir de la cellulose et de l’anhydride acétique: l’acétate de cellulose. Le polypropylène, dont on verra plus loin les utilisations en tant que matière plastique, peut également être employé sous forme de fibres courtes, en particulier dans l’industrie des tapis.Les plastiquesLes matières plastiques sont de très loin le groupe de polymères le plus important: ces produits représentent 75 p. 100 du tonnage des polymères fabriqués; leurs applications se multiplient très rapidement.Un premier groupe est constitué par des polymères d’hydrocarbures insaturés (éthylène, propylène, styrène). L’éthylène peut être polymérisé de trois façons. Sous haute pression (de 1,4 à 2,5 憐 10 8 Pa) et à des températures de 100 à 300 0C, en présence d’activateurs générateurs de radicaux (peroxydes, composés azoïques), on obtient un polymère de basse densité (de 0,915 à 0,935 g/cm3). À plus basse pression (de 0,7 à 3,4 憐 10 6 Pa) et à des températures de 80 à 130 0C, en présence d’alkylaluminium ou d’oxydes métalliques comme catalyseur, on obtient un polymère de haute densité (de 0,950 à 0,970 g/cm3). Enfin, en copolymérisant l’éthylène avec une autre oléfine (butène-1, hexène-1 ou octène-1), on obtient dans les mêmes conditions un polymère de basse densité avec une structure linéaire qui lui confère un point de fusion plus élevé (de 115 à 128 0C) et lui ouvre de nouvelles applications. On obtient ainsi toute une gamme de polymères parmi lesquels on peut choisir en fonction des applications envisagées (produits moulés, composants industriels, tubes, films pour l’emballage, récipients, etc.).Le polypropylène est le résultat de la polymérisation du propylène, en présence de trichlorure de titane et d’alkylaluminium (procédé Ziegler-Natta) qui réalise cette opération de telle sorte que les atomes de carbone du polymère se présentent dans l’espace d’une manière régulière et non statistique. C’est ainsi que le groupement carboné CH3 漣 du propylène est toujours disposé du même côté de la chaîne carbonée. Ce type de polymérisation, dit «stéréospécifique», confère au produit des qualités mécaniques particulièrement intéressantes, qui le rendent apte à des emplois industriels importants dans l’industrie textile, l’industrie automobile et l’électroménager.On utilise beaucoup les polymères du styrène, CH2=CH 漣 C6H5, sous des formes très diverses: les homopolymères transparents ou opaques, massifs ou expansés, auxquels l’industrie de l’emballage fait largement appel; par un mélange avec des élastomères, on obtient des produits qui présentent une résistance particulière au choc; copolymérisé avec l’acrylonitrile, le styrène permet d’obtenir des produits de bonne rigidité et de meilleure transparence.D’autres hydrocarbures peuvent être polymérisés, mais les produits obtenus ne se distinguent que peu des précédents; on y recherche une meilleure tenue à la chaleur (polybutène), associée à une transparence accrue (polyméthylpentène).À partir de produits organiques chlorés ou oxygénés, on peut obtenir des polymères dotés de propriétés nouvelles ou de moindre prix. À cette catégorie appartient le polymère du chlorure de vinyle (face=F0019 漣 CH2 漣 CHCl 漣)n qui connaît de nombreuses utilisations dans divers secteurs de l’industrie (tuyaux rigides ou souples, panneaux, jouets, revêtements de sol). Les polyesters, obtenus comme les fibres du même nom par condensation d’un diacide ou de son anhydride (anhydride phtalique, anhydride maléique), avec un diol, comme l’éthylène glycol, sont utilisés dans de nombreuses industries (carrosseries d’automobiles, coques de bateaux) soit purs, soit en mélange avec des fibres (verre, amiante) qui en renforcent les propriétés mécaniques.D’autres types de polymères, produits en moindre quantité, trouvent des usages importants dans les fabrications industrielles:– des résines obtenues à partir d’urée et de formol, de phénol et de formol, recherchées à cause de leurs propriétés adhésives et leur facilité à donner des produits moulés;– des polymères provenant d’éthers du propylène glycol [ 漣 O 漣 CH2 漣 CH(CH3) 漣 O 漣 CH2 漣 CH(CH3) 漣 O 漣] et de toluène di-isocyanate [NCO 漣 C6H3(CH3) 漣 NCO] dans la fabrication des diverses mousses (éponges, sièges);– des copolymères d’acrylonitrile, de butadiène et de styrène (résine ABS) dont font principalement usage l’industrie de l’électroménager et l’industrie de l’automobile (pièces moulées chromables, pièces thermo-formables pour carrosseries).Les engrais azotésBien que, pour obtenir les engrais azotés, on ne fasse pas appel au carbone contenu dans les produits pétroliers, on peut considérer qu’ils font partie des produits de la pétrochimie du fait que ce sont les hydrocarbures qui fournissent l’hydrogène nécessaire à leur préparation.Ces produits sont tous les dérivés de l’ammoniac, que l’on utilise:– soit sous forme de sa combinaison avec un acide minéral, acide sulfurique [sulfate d’ammonium S4(NH4)2] ou acide nitrique (nitrate d’ammonium 3NH4);– soit sous forme d’urée, obtenue par réaction sous pression avec le gaz carbonique:
par ses propriétés, il est très proche du Nylon-11 vendu en France sous le nom de Rilsan, dont le monomère est tiré de l’huile de ricin. Un autre type de fibre est fabriqué à partir d’un polyester obtenu par polycondensation d’un acide organique, l’acide téréphtalique (HOOC 漣 C6H4 漣 COOH), avec l’éthylène glycol (HOCH2 漣 CH2OH). Il est connu sous des noms commerciaux très divers (Tergal, Térylène, par exemple).Il existe aussi des fibres acryliques et vinyliques, qui doivent une large part de l’intérêt qu’on leur porte à la facilité que l’on a de les mélanger avec des fibres naturelles et avec de la laine en particulier. Le polymère acrylique est obtenu par polymérisation de l’acrylonitrile (CH2=CH 漣 CN). Le polymère vinylique l’est à partir de l’acétate de vinyle (CH3COO 漣 CH=CH2); cette fibre a progressivement supplanté une fibre artificielle obtenue à partir de la cellulose et de l’anhydride acétique: l’acétate de cellulose. Le polypropylène, dont on verra plus loin les utilisations en tant que matière plastique, peut également être employé sous forme de fibres courtes, en particulier dans l’industrie des tapis.Les plastiquesLes matières plastiques sont de très loin le groupe de polymères le plus important: ces produits représentent 75 p. 100 du tonnage des polymères fabriqués; leurs applications se multiplient très rapidement.Un premier groupe est constitué par des polymères d’hydrocarbures insaturés (éthylène, propylène, styrène). L’éthylène peut être polymérisé de trois façons. Sous haute pression (de 1,4 à 2,5 憐 10 8 Pa) et à des températures de 100 à 300 0C, en présence d’activateurs générateurs de radicaux (peroxydes, composés azoïques), on obtient un polymère de basse densité (de 0,915 à 0,935 g/cm3). À plus basse pression (de 0,7 à 3,4 憐 10 6 Pa) et à des températures de 80 à 130 0C, en présence d’alkylaluminium ou d’oxydes métalliques comme catalyseur, on obtient un polymère de haute densité (de 0,950 à 0,970 g/cm3). Enfin, en copolymérisant l’éthylène avec une autre oléfine (butène-1, hexène-1 ou octène-1), on obtient dans les mêmes conditions un polymère de basse densité avec une structure linéaire qui lui confère un point de fusion plus élevé (de 115 à 128 0C) et lui ouvre de nouvelles applications. On obtient ainsi toute une gamme de polymères parmi lesquels on peut choisir en fonction des applications envisagées (produits moulés, composants industriels, tubes, films pour l’emballage, récipients, etc.).Le polypropylène est le résultat de la polymérisation du propylène, en présence de trichlorure de titane et d’alkylaluminium (procédé Ziegler-Natta) qui réalise cette opération de telle sorte que les atomes de carbone du polymère se présentent dans l’espace d’une manière régulière et non statistique. C’est ainsi que le groupement carboné CH3 漣 du propylène est toujours disposé du même côté de la chaîne carbonée. Ce type de polymérisation, dit «stéréospécifique», confère au produit des qualités mécaniques particulièrement intéressantes, qui le rendent apte à des emplois industriels importants dans l’industrie textile, l’industrie automobile et l’électroménager.On utilise beaucoup les polymères du styrène, CH2=CH 漣 C6H5, sous des formes très diverses: les homopolymères transparents ou opaques, massifs ou expansés, auxquels l’industrie de l’emballage fait largement appel; par un mélange avec des élastomères, on obtient des produits qui présentent une résistance particulière au choc; copolymérisé avec l’acrylonitrile, le styrène permet d’obtenir des produits de bonne rigidité et de meilleure transparence.D’autres hydrocarbures peuvent être polymérisés, mais les produits obtenus ne se distinguent que peu des précédents; on y recherche une meilleure tenue à la chaleur (polybutène), associée à une transparence accrue (polyméthylpentène).À partir de produits organiques chlorés ou oxygénés, on peut obtenir des polymères dotés de propriétés nouvelles ou de moindre prix. À cette catégorie appartient le polymère du chlorure de vinyle (face=F0019 漣 CH2 漣 CHCl 漣)n qui connaît de nombreuses utilisations dans divers secteurs de l’industrie (tuyaux rigides ou souples, panneaux, jouets, revêtements de sol). Les polyesters, obtenus comme les fibres du même nom par condensation d’un diacide ou de son anhydride (anhydride phtalique, anhydride maléique), avec un diol, comme l’éthylène glycol, sont utilisés dans de nombreuses industries (carrosseries d’automobiles, coques de bateaux) soit purs, soit en mélange avec des fibres (verre, amiante) qui en renforcent les propriétés mécaniques.D’autres types de polymères, produits en moindre quantité, trouvent des usages importants dans les fabrications industrielles:– des résines obtenues à partir d’urée et de formol, de phénol et de formol, recherchées à cause de leurs propriétés adhésives et leur facilité à donner des produits moulés;– des polymères provenant d’éthers du propylène glycol [ 漣 O 漣 CH2 漣 CH(CH3) 漣 O 漣 CH2 漣 CH(CH3) 漣 O 漣] et de toluène di-isocyanate [NCO 漣 C6H3(CH3) 漣 NCO] dans la fabrication des diverses mousses (éponges, sièges);– des copolymères d’acrylonitrile, de butadiène et de styrène (résine ABS) dont font principalement usage l’industrie de l’électroménager et l’industrie de l’automobile (pièces moulées chromables, pièces thermo-formables pour carrosseries).Les engrais azotésBien que, pour obtenir les engrais azotés, on ne fasse pas appel au carbone contenu dans les produits pétroliers, on peut considérer qu’ils font partie des produits de la pétrochimie du fait que ce sont les hydrocarbures qui fournissent l’hydrogène nécessaire à leur préparation.Ces produits sont tous les dérivés de l’ammoniac, que l’on utilise:– soit sous forme de sa combinaison avec un acide minéral, acide sulfurique [sulfate d’ammonium S4(NH4)2] ou acide nitrique (nitrate d’ammonium 3NH4);– soit sous forme d’urée, obtenue par réaction sous pression avec le gaz carbonique: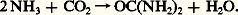 En pratique, ces produits, dont on fixe la valeur par la teneur en azote qu’ils contiennent, sont utilisés à l’état de cristaux solides, en les mélangeant le plus souvent avec d’autres composés phosphorés ou potassiques, nécessaires à l’entretien des sols cultivés. Dans certains cas, on pratique directement l’injection dans le sol d’ammoniac gazeux ou liquéfié.Les détergentsAyant progressivement remplacé les savons d’origine naturelle, les détergents sont constitués le plus souvent de composés organiques portant un groupe hydrophobe de nature hydrocarbonée et un groupe hydrophile formé d’un groupement acide neutralisé par la soude. Il s’agit de composés appelés «anioniques». Lorsque le groupement hydrocarboné est apporté par un alkylbenzène, on introduit le groupement hydrophile par action de l’acide sulfurique. Cette classe de produits s’appelle «alkylbenzène sulfonate de sodium». Pendant de nombreuses années, l’alkylbenzène le plus utilisé a été le dodécylbenzène; à cause des ramifications de la chaîne alkyle, ce produit ne se dégradait que très lentement dans les eaux de rivières où se trouvaient rejetées les eaux usées industrielles et ménagères. C’est pourquoi le dodécylbenzène actuellement employé ne présente qu’une seule ramification qui rend le produit fini suffisamment biodégradable.Lorsque le groupement hydrophobe est apporté par un hydrocarbure insaturé (oléfines à 16-18 atomes de carbone), on obtient, par action de l’acide sulfurique, un sulfate d’alkyle, neutralisé ensuite par la soude.À côté de ces produits qui sont d’usage courant, on en fabrique d’autres ayant des usages particuliers (cosmétiques, désuintage de la laine). Ce sont les sulfates d’alcools primaires, les composés non ioniques d’addition de l’oxyde d’éthylène et du phénol, les nonyl-phénols, les alcools gras à longue chaîne.Les additifs, solvants et plastifiantsOutre les engrais azotés et les détergents, la chimie du pétrole fournit d’importantes quantités d’intermédiaires utilisés pour améliorer la qualité ou pour faciliter l’emploi de nombreux autres produits. Il s’agit là de dérivés très divers qui représentent, pris isolément, des tonnages souvent faibles. On ne citera que les solvants et les plastifiants.Les solvants peuvent être des hydrocarbures purs ou en mélange (industrie des peintures, colles et vernis), des produits chlorés (trichloroéthylène, tétrachlorure de carbone), que l’on utilise pour le décapage des métaux et le nettoyage des vêtements, ou des solvants oxygénés (éthanol, acétone, alcool butylique), largement employés dans la synthèse industrielle.Les plastifiants sont des substances très utilisées dans la fabrication des plastiques pour apporter à ces produits la flexibilité et la souplesse nécessaires à la fabrication de certains objets (bouteilles, jouets, par exemple). Ils sont souvent constitués d’esters organiques de haut poids moléculaire (phtalate d’éthylhexyl, de butyl, d’octyl).D’autres additifs interviennent dans la formulation des essences (plomb tétraéthyle), des huiles lubrifiantes (polybuthènes, esters organiques ou organo-métalliques) et des polymères (anti-oxygènes).2. Matières premières de la pétrochimiePour assurer la fabrication de tous les produits finis que réclame l’évolution du marché, on prélève, parmi les fractions pétrolières fournies par le raffinage du pétrole brut ou par l’exploitation du gaz naturel, celles qui correspondent le mieux au but poursuivi. C’est ainsi que l’on a consommé en 1980, dans le monde, 200 millions de tonnes d’hydrocarbures pétroliers pour la pétrochimie, dont 130 millions de tonnes de fractions liquides et 70 millions de tonnes de fractions gazeuses. Cette quantité représente 5 p. 100 de l’ensemble des produits pétroliers consommés dans le monde.Hydrocarbures gazeuxLe méthane, constituant essentiel du gaz naturel, est particulièrement apte à fournir l’hydrogène nécessaire à la fabrication des engrais; il contient, en effet, de tous les hydrocarbures, le pourcentage le plus élevé en hydrogène (H/C = 4). Il peut aussi être utilisé dans la fabrication des polymères, par l’intermédiaire de l’acétylène obtenu par décomposition du méthane à haute température ou sous l’arc électrique.Souvent associés au méthane dans les gisements de gaz naturels, l’éthane, le propane et le butane peuvent constituer d’excellentes matières premières pour la synthèse chimique. Leur disponibilité reste cependant limitée aux zones où le gaz naturel est abondant. C’est le cas des États-Unis pour lesquels le gaz naturel et ses produits associés représentaient 29 millions de tonnes en 1970, soit 70 p. 100 de la totalité de ses besoins en hydrocarbures. C’est le cas aussi de l’industrie chimique, établie autour du gisement de Lacq. Toutefois, l’Europe, comme le Japon, qui ne dispose pas de gisements de gaz naturel suffisants, doit le plus souvent faire appel aux fractions liquides pour alimenter son industrie pétrochimique.Hydrocarbures liquidesEn Europe et au Japon, les hydrocarbures liquides représentent la quasi-totalité des matières premières destinées à la pétrochimie: 100 p. 100 au Japon, plus de 80 p. 100 en Europe. On peut utiliser des fractions d’essences légères appelées aussi «naphtas», dont l’intervalle de distillation est situé entre 35 et 175 0C. Ces produits conviennent aussi bien à la production d’hydrogène destiné à la fabrication des engrais qu’à celle des intermédiaires chimiques et des monomères destinés à l’obtention des plastiques, des fibres et des résines.Les produits plus lourds (kérosène et gazole, cire de paraffine) sont réservés à des usages spécifiques: bases pour détergents (paraffines normales, oléfines linéaires), protéines de synthèse. Les produits encore plus lourds (résidus) sont employés pour la fabrication de noir de carbone (charge des pneumatiques), de coke pour électrode (fabrication de l’aluminium). Signalons enfin que des tentatives sont faites pour utiliser le pétrole brut complet comme matière première directe de la pétrochimie, particulièrement au Japon et en France.3. Procédés de la pétrochimieLa transformation des matières premières, pour obtenir les produits finis livrés à la consommation, comprend de nombreuses étapes successives, au cours desquelles la structure finale du produit recherché prend forme.En fait, au départ de leur fabrication, on trouve un nombre limité de composés simples que l’on obtient grâce à des opérations primaires qui convertissent les hydrocarbures de base, peu réactifs par nature, en des intermédiaires chimiques plus réactifs. Ces opérations primaires sont, par ordre d’importance industrielle (fig. 1):– la pyrolyse, ou craquage à la vapeur, source d’hydrocarbures insaturés et aromatiques;– la conversion en hydrogène et gaz carbonique, soit par traitement catalytique par la vapeur d’eau, soit par oxydation partielle;– l’aromatisation, ou reforming catalytique, source d’hydrocarbures aromatiques.Le craquage à la vapeurLe craquage à la vapeur permet de produire les principaux hydrocarbures insaturés oléfiniques (éthylène, propylène, butènes), dioléfiniques (butadiène), aromatiques (benzène, toluène et, pour une faible part, xylènes).Par une suite de réactions endothermiques, les hydrocarbures de la matière première, soumis à l’intérieur d’une série de tubes à une température de 800-850 0C en présence de vapeur d’eau dans un rapport voisin de 0,5 en poids, sont transformés en un mélange complexe de produits que des méthodes physiques ou chimiques parviennent à séparer et à purifier. Les tubes de fours dans lesquels se produisent les réactions sont chauffés par un ensemble de brûleurs qui assurent l’apport de chaleur nécessaire. Les produits sont refroidis à la sortie du four par des chaudières qui récupèrent environ 50 p. 100 de la chaleur contenue et qui, grâce à leur efficacité, évitent que la composition du produit n’évolue par une succession de réactions parasites. Le mélange est alors envoyé dans une section de fractionnement à basse température (face=F0019 漣 17 à 漣 100 0C), où s’opère la séparation des principaux constituants; pour certains d’entre eux (butadiène, benzène et toluène), on doit faire appel à des types de séparation de haute sélectivité: distillation extractive pour le butadiène, extraction par solvant pour les deux autres. Certaines impuretés sont éliminées par des méthodes particulières: traitement à la soude pour l’hydrogène sulfuré et le gaz carbonique, hydrogénation pour les acétyléniques, absorption sur alumine pour l’eau. L’ensemble de l’opération permet d’obtenir, avec des matières premières liquides et suivant les conditions opératoires utilisées: l’éthylène (25 à 30 p. 100 en poids de la charge), le propylène (14 à 18 p. 100), le butadiène (3,5 à 4,2 p. 100), le benzène (6 à 7,5 p. 100), et le toluène (3 à 4,5 p. 100).Les autres produits sont utilisés pour la chauffe (hydrogène, méthane, résidus lourds) ou soumis à de nouvelles purifications pour en extraire certains constituants (isobutène, butène -1 et -2, cyclopentadiène et isoprène).Les produits principaux du craquage à la vapeur sont utilisés soit directement dans les polymérisations (éthylène, propylène, butadiène), soit dans de nouvelles réactions: oxydation, chloration, alkylation, notamment. L’importance relative des produits fournis par ces réactions est marquée au tableau 1 pour chacun des principaux produits du craquage à la vapeur. La destination industrielle finale de ces produits est donnée au chapitre 4.Conversion en hydrogèneLa conversion en hydrogène peut être réalisée de deux manières, soit à l’aide de la vapeur d’eau, soit par oxydation partielle à l’oxygène.La réaction entre les hydrocarbures et la vapeur d’eau s’effectue en présence de catalyseur au nickel. Pour le méthane, on a:
En pratique, ces produits, dont on fixe la valeur par la teneur en azote qu’ils contiennent, sont utilisés à l’état de cristaux solides, en les mélangeant le plus souvent avec d’autres composés phosphorés ou potassiques, nécessaires à l’entretien des sols cultivés. Dans certains cas, on pratique directement l’injection dans le sol d’ammoniac gazeux ou liquéfié.Les détergentsAyant progressivement remplacé les savons d’origine naturelle, les détergents sont constitués le plus souvent de composés organiques portant un groupe hydrophobe de nature hydrocarbonée et un groupe hydrophile formé d’un groupement acide neutralisé par la soude. Il s’agit de composés appelés «anioniques». Lorsque le groupement hydrocarboné est apporté par un alkylbenzène, on introduit le groupement hydrophile par action de l’acide sulfurique. Cette classe de produits s’appelle «alkylbenzène sulfonate de sodium». Pendant de nombreuses années, l’alkylbenzène le plus utilisé a été le dodécylbenzène; à cause des ramifications de la chaîne alkyle, ce produit ne se dégradait que très lentement dans les eaux de rivières où se trouvaient rejetées les eaux usées industrielles et ménagères. C’est pourquoi le dodécylbenzène actuellement employé ne présente qu’une seule ramification qui rend le produit fini suffisamment biodégradable.Lorsque le groupement hydrophobe est apporté par un hydrocarbure insaturé (oléfines à 16-18 atomes de carbone), on obtient, par action de l’acide sulfurique, un sulfate d’alkyle, neutralisé ensuite par la soude.À côté de ces produits qui sont d’usage courant, on en fabrique d’autres ayant des usages particuliers (cosmétiques, désuintage de la laine). Ce sont les sulfates d’alcools primaires, les composés non ioniques d’addition de l’oxyde d’éthylène et du phénol, les nonyl-phénols, les alcools gras à longue chaîne.Les additifs, solvants et plastifiantsOutre les engrais azotés et les détergents, la chimie du pétrole fournit d’importantes quantités d’intermédiaires utilisés pour améliorer la qualité ou pour faciliter l’emploi de nombreux autres produits. Il s’agit là de dérivés très divers qui représentent, pris isolément, des tonnages souvent faibles. On ne citera que les solvants et les plastifiants.Les solvants peuvent être des hydrocarbures purs ou en mélange (industrie des peintures, colles et vernis), des produits chlorés (trichloroéthylène, tétrachlorure de carbone), que l’on utilise pour le décapage des métaux et le nettoyage des vêtements, ou des solvants oxygénés (éthanol, acétone, alcool butylique), largement employés dans la synthèse industrielle.Les plastifiants sont des substances très utilisées dans la fabrication des plastiques pour apporter à ces produits la flexibilité et la souplesse nécessaires à la fabrication de certains objets (bouteilles, jouets, par exemple). Ils sont souvent constitués d’esters organiques de haut poids moléculaire (phtalate d’éthylhexyl, de butyl, d’octyl).D’autres additifs interviennent dans la formulation des essences (plomb tétraéthyle), des huiles lubrifiantes (polybuthènes, esters organiques ou organo-métalliques) et des polymères (anti-oxygènes).2. Matières premières de la pétrochimiePour assurer la fabrication de tous les produits finis que réclame l’évolution du marché, on prélève, parmi les fractions pétrolières fournies par le raffinage du pétrole brut ou par l’exploitation du gaz naturel, celles qui correspondent le mieux au but poursuivi. C’est ainsi que l’on a consommé en 1980, dans le monde, 200 millions de tonnes d’hydrocarbures pétroliers pour la pétrochimie, dont 130 millions de tonnes de fractions liquides et 70 millions de tonnes de fractions gazeuses. Cette quantité représente 5 p. 100 de l’ensemble des produits pétroliers consommés dans le monde.Hydrocarbures gazeuxLe méthane, constituant essentiel du gaz naturel, est particulièrement apte à fournir l’hydrogène nécessaire à la fabrication des engrais; il contient, en effet, de tous les hydrocarbures, le pourcentage le plus élevé en hydrogène (H/C = 4). Il peut aussi être utilisé dans la fabrication des polymères, par l’intermédiaire de l’acétylène obtenu par décomposition du méthane à haute température ou sous l’arc électrique.Souvent associés au méthane dans les gisements de gaz naturels, l’éthane, le propane et le butane peuvent constituer d’excellentes matières premières pour la synthèse chimique. Leur disponibilité reste cependant limitée aux zones où le gaz naturel est abondant. C’est le cas des États-Unis pour lesquels le gaz naturel et ses produits associés représentaient 29 millions de tonnes en 1970, soit 70 p. 100 de la totalité de ses besoins en hydrocarbures. C’est le cas aussi de l’industrie chimique, établie autour du gisement de Lacq. Toutefois, l’Europe, comme le Japon, qui ne dispose pas de gisements de gaz naturel suffisants, doit le plus souvent faire appel aux fractions liquides pour alimenter son industrie pétrochimique.Hydrocarbures liquidesEn Europe et au Japon, les hydrocarbures liquides représentent la quasi-totalité des matières premières destinées à la pétrochimie: 100 p. 100 au Japon, plus de 80 p. 100 en Europe. On peut utiliser des fractions d’essences légères appelées aussi «naphtas», dont l’intervalle de distillation est situé entre 35 et 175 0C. Ces produits conviennent aussi bien à la production d’hydrogène destiné à la fabrication des engrais qu’à celle des intermédiaires chimiques et des monomères destinés à l’obtention des plastiques, des fibres et des résines.Les produits plus lourds (kérosène et gazole, cire de paraffine) sont réservés à des usages spécifiques: bases pour détergents (paraffines normales, oléfines linéaires), protéines de synthèse. Les produits encore plus lourds (résidus) sont employés pour la fabrication de noir de carbone (charge des pneumatiques), de coke pour électrode (fabrication de l’aluminium). Signalons enfin que des tentatives sont faites pour utiliser le pétrole brut complet comme matière première directe de la pétrochimie, particulièrement au Japon et en France.3. Procédés de la pétrochimieLa transformation des matières premières, pour obtenir les produits finis livrés à la consommation, comprend de nombreuses étapes successives, au cours desquelles la structure finale du produit recherché prend forme.En fait, au départ de leur fabrication, on trouve un nombre limité de composés simples que l’on obtient grâce à des opérations primaires qui convertissent les hydrocarbures de base, peu réactifs par nature, en des intermédiaires chimiques plus réactifs. Ces opérations primaires sont, par ordre d’importance industrielle (fig. 1):– la pyrolyse, ou craquage à la vapeur, source d’hydrocarbures insaturés et aromatiques;– la conversion en hydrogène et gaz carbonique, soit par traitement catalytique par la vapeur d’eau, soit par oxydation partielle;– l’aromatisation, ou reforming catalytique, source d’hydrocarbures aromatiques.Le craquage à la vapeurLe craquage à la vapeur permet de produire les principaux hydrocarbures insaturés oléfiniques (éthylène, propylène, butènes), dioléfiniques (butadiène), aromatiques (benzène, toluène et, pour une faible part, xylènes).Par une suite de réactions endothermiques, les hydrocarbures de la matière première, soumis à l’intérieur d’une série de tubes à une température de 800-850 0C en présence de vapeur d’eau dans un rapport voisin de 0,5 en poids, sont transformés en un mélange complexe de produits que des méthodes physiques ou chimiques parviennent à séparer et à purifier. Les tubes de fours dans lesquels se produisent les réactions sont chauffés par un ensemble de brûleurs qui assurent l’apport de chaleur nécessaire. Les produits sont refroidis à la sortie du four par des chaudières qui récupèrent environ 50 p. 100 de la chaleur contenue et qui, grâce à leur efficacité, évitent que la composition du produit n’évolue par une succession de réactions parasites. Le mélange est alors envoyé dans une section de fractionnement à basse température (face=F0019 漣 17 à 漣 100 0C), où s’opère la séparation des principaux constituants; pour certains d’entre eux (butadiène, benzène et toluène), on doit faire appel à des types de séparation de haute sélectivité: distillation extractive pour le butadiène, extraction par solvant pour les deux autres. Certaines impuretés sont éliminées par des méthodes particulières: traitement à la soude pour l’hydrogène sulfuré et le gaz carbonique, hydrogénation pour les acétyléniques, absorption sur alumine pour l’eau. L’ensemble de l’opération permet d’obtenir, avec des matières premières liquides et suivant les conditions opératoires utilisées: l’éthylène (25 à 30 p. 100 en poids de la charge), le propylène (14 à 18 p. 100), le butadiène (3,5 à 4,2 p. 100), le benzène (6 à 7,5 p. 100), et le toluène (3 à 4,5 p. 100).Les autres produits sont utilisés pour la chauffe (hydrogène, méthane, résidus lourds) ou soumis à de nouvelles purifications pour en extraire certains constituants (isobutène, butène -1 et -2, cyclopentadiène et isoprène).Les produits principaux du craquage à la vapeur sont utilisés soit directement dans les polymérisations (éthylène, propylène, butadiène), soit dans de nouvelles réactions: oxydation, chloration, alkylation, notamment. L’importance relative des produits fournis par ces réactions est marquée au tableau 1 pour chacun des principaux produits du craquage à la vapeur. La destination industrielle finale de ces produits est donnée au chapitre 4.Conversion en hydrogèneLa conversion en hydrogène peut être réalisée de deux manières, soit à l’aide de la vapeur d’eau, soit par oxydation partielle à l’oxygène.La réaction entre les hydrocarbures et la vapeur d’eau s’effectue en présence de catalyseur au nickel. Pour le méthane, on a: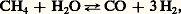 ou bien:
ou bien: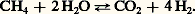 Compte tenu des caractéristiques thermodynamiques de ces réactions, on devrait opérer à basse pression (réaction exentropique) et à une température supérieure à 500 0C (réaction endothermique). En pratique, comme il est intéressant de disposer de gaz sous pression pour effectuer économiquement le traitement et la distribution, on préfère opérer sous 10 à 20 atmosphères. Pour compenser l’action néfaste de cette augmentation de pression sur l’équilibre thermodynamique, on doit porter la température de réaction à 750-800 0C. Dans ces conditions, on obtient un mélange d’hydrogène, de gaz carbonique, d’oxyde de carbone, de vapeur d’eau et d’hydrocarbure non converti. Avant d’en effectuer la résolution, on met à profit la réactivité de l’oxyde de carbone qui, en réagissant à basse température (300-350 0C) avec la vapeur d’eau, en présence de catalyseur (Ni, Cr, Zn), fournit une quantité supplémentaire d’hydrogène:
Compte tenu des caractéristiques thermodynamiques de ces réactions, on devrait opérer à basse pression (réaction exentropique) et à une température supérieure à 500 0C (réaction endothermique). En pratique, comme il est intéressant de disposer de gaz sous pression pour effectuer économiquement le traitement et la distribution, on préfère opérer sous 10 à 20 atmosphères. Pour compenser l’action néfaste de cette augmentation de pression sur l’équilibre thermodynamique, on doit porter la température de réaction à 750-800 0C. Dans ces conditions, on obtient un mélange d’hydrogène, de gaz carbonique, d’oxyde de carbone, de vapeur d’eau et d’hydrocarbure non converti. Avant d’en effectuer la résolution, on met à profit la réactivité de l’oxyde de carbone qui, en réagissant à basse température (300-350 0C) avec la vapeur d’eau, en présence de catalyseur (Ni, Cr, Zn), fournit une quantité supplémentaire d’hydrogène: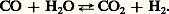 De la sorte, la teneur en oxyde de carbone du gaz peut diminuer jusqu’à 0,5-2 p. 100, alors que celle de l’hydrogène atteint 75-80 p. 100 en volume.Le traitement de purification comporte l’absorption du gaz carbonique par un solvant sélectif (en particulier, eau sous pression, carbonate de potassium, solvant organique, éthanolamine, sulfolane), et l’élimination de l’oxyde de carbone par hydrogénation en méthane. On obtient alors de l’hydrogène qui contient des traces d’hydrocarbures (1 à 3 p. 100).Si l’on désire parvenir au gaz correspondant à la synthèse de l’ammoniac (N2 + 3H2), on procède, avant les opérations précédentes, à une oxydation partielle du méthane résiduaire par de l’air, introduit en quantité telle qu’en fin d’opération l’azote et l’hydrogène se trouvent dans les proportions convenables (un volume d’azote pour trois volumes d’hydrogène).Si on veut préparer un gaz destiné à la synthèse du méthanol (CO + 2H2), on évitera la conversion complète de l’oxyde de carbone, ou encore on enrichira le mélange de charge en carbone par recyclage de gaz carbonique.On peut aussi utiliser l’oxydation partielle des hydrocarbures à l’oxygène. Pour le méthane, on a:
De la sorte, la teneur en oxyde de carbone du gaz peut diminuer jusqu’à 0,5-2 p. 100, alors que celle de l’hydrogène atteint 75-80 p. 100 en volume.Le traitement de purification comporte l’absorption du gaz carbonique par un solvant sélectif (en particulier, eau sous pression, carbonate de potassium, solvant organique, éthanolamine, sulfolane), et l’élimination de l’oxyde de carbone par hydrogénation en méthane. On obtient alors de l’hydrogène qui contient des traces d’hydrocarbures (1 à 3 p. 100).Si l’on désire parvenir au gaz correspondant à la synthèse de l’ammoniac (N2 + 3H2), on procède, avant les opérations précédentes, à une oxydation partielle du méthane résiduaire par de l’air, introduit en quantité telle qu’en fin d’opération l’azote et l’hydrogène se trouvent dans les proportions convenables (un volume d’azote pour trois volumes d’hydrogène).Si on veut préparer un gaz destiné à la synthèse du méthanol (CO + 2H2), on évitera la conversion complète de l’oxyde de carbone, ou encore on enrichira le mélange de charge en carbone par recyclage de gaz carbonique.On peut aussi utiliser l’oxydation partielle des hydrocarbures à l’oxygène. Pour le méthane, on a: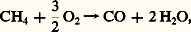 ainsi que:
ainsi que: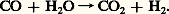 Cette méthode présente l’avantage de pouvoir être conduite à haute pression, mais elle se heurte à divers inconvénients: il y a formation de suie dont l’élimination est souvent délicate, et l’oxygène utilisé doit être préparé, par distillation de l’air, au prix d’une dépense énergétique sensible. La suite des opérations de traitement est, dans son principe, analogue à celle des gaz issus du traitement à la vapeur.Aromatisation, ou «reforming» catalytiqueLe reforming produit des hydrocarbures aromatiques: benzène, toluène, xylène. En Europe et au Japon, une grande partie d’entre eux provient du craquage à la vapeur des essences, si bien qu’on ne recourt à ce procédé que dans des cas particuliers, qui peuvent résulter soit d’un manque local de benzène, soit de la nécessité d’assurer une production de xylènes que le craquage à la vapeur ne fournit qu’en trop faible quantité.Aux États-Unis, où se pratique plutôt le craquage des gaz légers (éthane, propane) sans formation de benzénoïdes, le reforming catalytique est largement utilisé. Il consiste à convertir certains constituants d’une essence en hydrocarbures aromatiques par action d’un catalyseur constitué de platine déposé sur une silico-alumine. Son action est double: il déshydrogénise les cycloparaffines (naphtènes): C6H12C6H6 + 3H2, et il cyclise les paraffines et isoparaffines:
Cette méthode présente l’avantage de pouvoir être conduite à haute pression, mais elle se heurte à divers inconvénients: il y a formation de suie dont l’élimination est souvent délicate, et l’oxygène utilisé doit être préparé, par distillation de l’air, au prix d’une dépense énergétique sensible. La suite des opérations de traitement est, dans son principe, analogue à celle des gaz issus du traitement à la vapeur.Aromatisation, ou «reforming» catalytiqueLe reforming produit des hydrocarbures aromatiques: benzène, toluène, xylène. En Europe et au Japon, une grande partie d’entre eux provient du craquage à la vapeur des essences, si bien qu’on ne recourt à ce procédé que dans des cas particuliers, qui peuvent résulter soit d’un manque local de benzène, soit de la nécessité d’assurer une production de xylènes que le craquage à la vapeur ne fournit qu’en trop faible quantité.Aux États-Unis, où se pratique plutôt le craquage des gaz légers (éthane, propane) sans formation de benzénoïdes, le reforming catalytique est largement utilisé. Il consiste à convertir certains constituants d’une essence en hydrocarbures aromatiques par action d’un catalyseur constitué de platine déposé sur une silico-alumine. Son action est double: il déshydrogénise les cycloparaffines (naphtènes): C6H12C6H6 + 3H2, et il cyclise les paraffines et isoparaffines: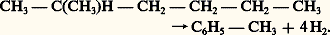 Du mélange obtenu, on extrait, à l’aide de solvant sélectif, les hydrocarbures aromatiques contenus. Cette méthode permet, en particulier, de produire l’orthoxylène et le paraxylène, tous deux indispensables à la fabrication des polyesters (fibres et résines). La séparation des isomères des xylènes (méta-, para-, ortho-) qui ne peut être réalisée par de simples distillations à cause de leurs points d’ébullition trop voisins, est effectuée soit par cristallisation fractionnée, soit par adsorption sélective sur solide.4. Opérations intermédiairesOn a vu que les opérations primaires de la pétrochimie ne conduisent qu’imparfaitement aux produits nécessaires aux transformations finales (polymérisation, polycondensation). On procède alors à de nouvelles réactions caractéristiques du produit de départ et du produit visé. Les figures 2, 3 et 4 résument les plus importantes d’entre elles; pour la plupart, elles font intervenir des réactifs apportant un hétéro-atome (N, S, O, Cl) dans la molécule hydrocarbonée de départ, créant une structure organique nouvelle douée de propriétés spécifiques qui se manifesteront dans le produit fini.5. Le complexe pétrochimiqueÀ l’examen des figures précédentes, il apparaît que le nombre de transformations nécessaires pour passer de la matière première aux produits finis est souvent grand, en particulier en ce qui concerne les fibres synthétiques, certains polyesters et les résines. En outre, certaines opérations de base, comme le craquage à la vapeur, fournissent simultanément de nombreux produits dont les proportions ne peuvent varier que faiblement lorsqu’on change la matière première, ou que l’on modifie les conditions opératoires. Enfin, certains produits sont coûteux à transporter sur de longues distances (éthylène, propylène, formol, ammoniac). C’est ainsi qu’apparaît l’intérêt de grouper, autour d’une opération primaire, un ensemble de fabrications. De là est née la notion de complexe pétrochimique. Comme on recherche, pour les usines de production, la taille la plus grande possible (tabl. 2) aussi bien pour satisfaire la demande que pour avoir des charges de capital rapportées à la tonne produite de plus en plus faibles, on conçoit que de tels complexes peuvent être gigantesques. Il y a, cependant, une limite à l’accroissement de la taille des usines: en effet, pour profiter pleinement des avantages économiques et financiers des grandes installations, il est nécessaire de maintenir leur durée de fonctionnement annuel à un niveau élevé. Une demande de produits momentanément réduite ou des incidents de marche imprévus peuvent conduire à des périodes d’arrêt plus ou moins longues ou à un fonctionnement à production ralentie, réduisant ou même annulant les avantages économiques attendus. C’est pourquoi, depuis 1972, on a cessé la course au gigantisme des installations pour se consacrer à l’adaptation de l’outil de production aux conditions économiques. Les complexes pétrochimiques peuvent être le résultat de regroupements, soit autour de l’utilisation d’une même matière première, soit encore autour de la valorisation de produits de même type (engrais, fibres, plastiques). À titre d’exemple, on décrira ici quelques types particuliers.Le complexe producteur d’engrais et de méthanolLe complexe producteur d’engrais et de méthanol comporte, comme opérations primaires, une conversion à la vapeur d’hydrocarbures (méthane ou essence) ou une oxydation partielle d’hydrocarbures lourds, qui alimente les installations de synthèse d’ammoniac et de méthanol. Un tel complexe comprend également une usine d’acide sulfurique utilisant du soufre élémentaire, disponible sur le site ou transporté.À ces installations s’ajoutent des usines d’acide nitrique, d’urée, de nitrate et de sulfate d’ammonium. Il peut s’y joindre une usine d’acide phosphorique et de phosphate qui utilise une partie de l’acide sulfurique produit par ailleurs.Le complexe producteur d’intermédiaires chimiquesLe plus souvent, un complexe producteur d’intermédiaires chimiques comporte, comme opérations primaires, le craquage à la vapeur et le reforming catalytique, ou l’un des deux seulement. Les fabrications situées en aval peuvent être diverses. Elles peuvent comporter la transformation des produits les plus coûteux à transporter (éthylène, propylène) ou la séparation des coupes complexes (coupe C4 en butadiène et isobutène, coupe C5 en isoprène, coupe C8 en ortho et paraxylène). Certaines opérations, situées plus en aval, peuvent y être adjointes (cyclohexane, cumène, phénol, acide téréphtalique).Cependant, le progrès des techniques de transport (pipe-line, tanker de produits chimiques) tend à rendre économique l’installation d’usines périphériques à des distances de plusieurs centaines de kilomètres. Ainsi, alors qu’en Angleterre le complexe d’Imperial Chemical Industries reste concentré autour de Wilton, l’unité de craquage à la vapeur de la société Elf, à Feyzin, alimente par pipe-line plusieurs usines, éloignées de plusieurs centaines de kilomètres.On conçoit ainsi que la notion de complexe pétrochimique recouvre, suivant les cas, des réalités bien différentes. Une généralisation plus hardie encore a conduit à la notion de raffinerie pétrochimique; on peut, en effet, imaginer une usine alimentée non plus en fractions pétrolières sélectionnées, mais en pétrole brut; elle en assurerait la conversion totale en produits chimiques, déduction faite de ses propres besoins énergétiques. Sur le plan technique, cette idée repose sur la constatation que les opérations primaires, judicieusement combinées, peuvent convertir en dérivés organiques et en engrais toutes les fractions pétrolières, des plus légères aux plus lourdes.Des considérations économiques (importance des investissements, contraintes dues aux productions liées en face des fluctuations particulières des marchés) ont été jusqu’ici un obstacle à la réalisation intégrale de tels complexes; cependant, on a construit à Priolo en Italie, à Algésiras en Espagne et à Francfort-sur-l’Oder (ex-R.D.A.) des ensembles d’installations qui transforment en produits chimiques une part importante (de 40 à 60 p. 100) du pétrole brut qu’elles consomment, mais ne produisent qu’une faible quantité de produits à usages énergétiques.
Du mélange obtenu, on extrait, à l’aide de solvant sélectif, les hydrocarbures aromatiques contenus. Cette méthode permet, en particulier, de produire l’orthoxylène et le paraxylène, tous deux indispensables à la fabrication des polyesters (fibres et résines). La séparation des isomères des xylènes (méta-, para-, ortho-) qui ne peut être réalisée par de simples distillations à cause de leurs points d’ébullition trop voisins, est effectuée soit par cristallisation fractionnée, soit par adsorption sélective sur solide.4. Opérations intermédiairesOn a vu que les opérations primaires de la pétrochimie ne conduisent qu’imparfaitement aux produits nécessaires aux transformations finales (polymérisation, polycondensation). On procède alors à de nouvelles réactions caractéristiques du produit de départ et du produit visé. Les figures 2, 3 et 4 résument les plus importantes d’entre elles; pour la plupart, elles font intervenir des réactifs apportant un hétéro-atome (N, S, O, Cl) dans la molécule hydrocarbonée de départ, créant une structure organique nouvelle douée de propriétés spécifiques qui se manifesteront dans le produit fini.5. Le complexe pétrochimiqueÀ l’examen des figures précédentes, il apparaît que le nombre de transformations nécessaires pour passer de la matière première aux produits finis est souvent grand, en particulier en ce qui concerne les fibres synthétiques, certains polyesters et les résines. En outre, certaines opérations de base, comme le craquage à la vapeur, fournissent simultanément de nombreux produits dont les proportions ne peuvent varier que faiblement lorsqu’on change la matière première, ou que l’on modifie les conditions opératoires. Enfin, certains produits sont coûteux à transporter sur de longues distances (éthylène, propylène, formol, ammoniac). C’est ainsi qu’apparaît l’intérêt de grouper, autour d’une opération primaire, un ensemble de fabrications. De là est née la notion de complexe pétrochimique. Comme on recherche, pour les usines de production, la taille la plus grande possible (tabl. 2) aussi bien pour satisfaire la demande que pour avoir des charges de capital rapportées à la tonne produite de plus en plus faibles, on conçoit que de tels complexes peuvent être gigantesques. Il y a, cependant, une limite à l’accroissement de la taille des usines: en effet, pour profiter pleinement des avantages économiques et financiers des grandes installations, il est nécessaire de maintenir leur durée de fonctionnement annuel à un niveau élevé. Une demande de produits momentanément réduite ou des incidents de marche imprévus peuvent conduire à des périodes d’arrêt plus ou moins longues ou à un fonctionnement à production ralentie, réduisant ou même annulant les avantages économiques attendus. C’est pourquoi, depuis 1972, on a cessé la course au gigantisme des installations pour se consacrer à l’adaptation de l’outil de production aux conditions économiques. Les complexes pétrochimiques peuvent être le résultat de regroupements, soit autour de l’utilisation d’une même matière première, soit encore autour de la valorisation de produits de même type (engrais, fibres, plastiques). À titre d’exemple, on décrira ici quelques types particuliers.Le complexe producteur d’engrais et de méthanolLe complexe producteur d’engrais et de méthanol comporte, comme opérations primaires, une conversion à la vapeur d’hydrocarbures (méthane ou essence) ou une oxydation partielle d’hydrocarbures lourds, qui alimente les installations de synthèse d’ammoniac et de méthanol. Un tel complexe comprend également une usine d’acide sulfurique utilisant du soufre élémentaire, disponible sur le site ou transporté.À ces installations s’ajoutent des usines d’acide nitrique, d’urée, de nitrate et de sulfate d’ammonium. Il peut s’y joindre une usine d’acide phosphorique et de phosphate qui utilise une partie de l’acide sulfurique produit par ailleurs.Le complexe producteur d’intermédiaires chimiquesLe plus souvent, un complexe producteur d’intermédiaires chimiques comporte, comme opérations primaires, le craquage à la vapeur et le reforming catalytique, ou l’un des deux seulement. Les fabrications situées en aval peuvent être diverses. Elles peuvent comporter la transformation des produits les plus coûteux à transporter (éthylène, propylène) ou la séparation des coupes complexes (coupe C4 en butadiène et isobutène, coupe C5 en isoprène, coupe C8 en ortho et paraxylène). Certaines opérations, situées plus en aval, peuvent y être adjointes (cyclohexane, cumène, phénol, acide téréphtalique).Cependant, le progrès des techniques de transport (pipe-line, tanker de produits chimiques) tend à rendre économique l’installation d’usines périphériques à des distances de plusieurs centaines de kilomètres. Ainsi, alors qu’en Angleterre le complexe d’Imperial Chemical Industries reste concentré autour de Wilton, l’unité de craquage à la vapeur de la société Elf, à Feyzin, alimente par pipe-line plusieurs usines, éloignées de plusieurs centaines de kilomètres.On conçoit ainsi que la notion de complexe pétrochimique recouvre, suivant les cas, des réalités bien différentes. Une généralisation plus hardie encore a conduit à la notion de raffinerie pétrochimique; on peut, en effet, imaginer une usine alimentée non plus en fractions pétrolières sélectionnées, mais en pétrole brut; elle en assurerait la conversion totale en produits chimiques, déduction faite de ses propres besoins énergétiques. Sur le plan technique, cette idée repose sur la constatation que les opérations primaires, judicieusement combinées, peuvent convertir en dérivés organiques et en engrais toutes les fractions pétrolières, des plus légères aux plus lourdes.Des considérations économiques (importance des investissements, contraintes dues aux productions liées en face des fluctuations particulières des marchés) ont été jusqu’ici un obstacle à la réalisation intégrale de tels complexes; cependant, on a construit à Priolo en Italie, à Algésiras en Espagne et à Francfort-sur-l’Oder (ex-R.D.A.) des ensembles d’installations qui transforment en produits chimiques une part importante (de 40 à 60 p. 100) du pétrole brut qu’elles consomment, mais ne produisent qu’une faible quantité de produits à usages énergétiques.
Encyclopédie Universelle. 2012.
